19. Espectros de emissão e absorção
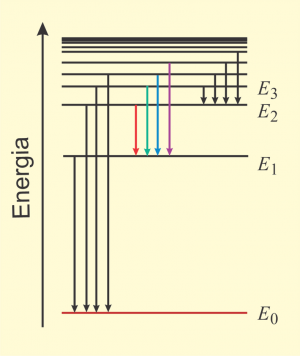
Um átomo pode ter valores discretos de energia a partir de um valor mínimo, que é a energia do estado fundamental. Quando absorve energia, o átomo passa para um estado excitado de maior energia. Normalmente, um átomo ou molécula excitado retorna rapidamente para um estado de menor energia ou para o estado fundamental e, nessa transição, é emitido um fóton com energia igual à diferença de energia entre os dois estados. Como há infinitos estados, há muitas transições possíveis, e cada uma dá origem a luz com um comprimento de onda específico. Esse conjunto de comprimentos de onda emitidos é chamado de espectro de emissão e é característico de cada átomo ou molécula, podendo ser usado para determinar a composição de um material. |
|
| Um dos equipamentos utilizados para se analisar o espectro de emissão de um material é o espectroscópio. Nesse instrumento, a luz a ser analisada passa por um prisma ou por uma rede de difração que separa os diferentes comprimentos de onda emitidos pela fonte. Como a luz entra nesses instrumentos através de uma fenda, o espectro aparece como uma série de linhas de luz de diferentes comprimentos de onda. Na figura, estão mostradas as linhas do espectro de emissão do átomo de hidrogênio na faixa de luz visível. |
Espectro de emissão do átomo de hidrogênio. |
| Quando luz branca atravessa um gás de um determinado átomo, os fótons que têm energia igual à de uma determinada transição podem ser absorvidos pelo átomo. Nesse caso, as componentes da luz branca que são absorvidas aparecem com uma série de linhas escuras no espectro, correspondentes aos comprimentos de onda que foram absorvidos pelo gás. Na figura, está mostrado o espectro de absorção do átomo de hidrogênio. Observe que os comprimentos de onda da luz emitida pelo átomo são iguais aos comprimentos de onda que são absorvidos, pois ambos estão associados ao mesmo conjunto de transições. |
Espectro de absorção do átomo de hidrogênio. |
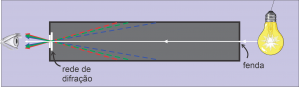
| Neste experimento, os estudantes utilizarão espectroscópios de rede de difração para analisar o espectro de emissão de diferentes fontes de luz e o espectro de absorção de alguns materiais. Para entender o princípio de funcionamento desse instrumento, veja a descrição do experimento Rede de difração – difração da luz branca. A luz a ser analisada entra pela fenda do espectroscópio e passa pelo tubo em direção à rede de difração, onde os diferentes comprimentos de onda difratam-se em diferentes ângulos. Para o observador, a luz difratada vem das direções indicadas pelas linhas tracejadas e ele vê os espectros dispostos simetricamente nas paredes laterais do espectroscópio. |
 |
Experimentos
Espectro de emissão de diferentes fontes de luz
|
O espectroscópio Uma das tampas do espectroscópio tem uma rede de difração e a outra tem uma fenda. |
|
Cada estudante deverá utilizar o espectroscópio para analisar a luz emitida por diferentes fontes. Ele deve segurar o espectroscópio com a rede de difração próxima ao olho. A câmera de um telefone celular pode ser utilizada para fotografar os espectros. Para isso, deve-se posicionar a lente da câmera sobre a tampa com a rede de difração e ajustar o foco para obter uma imagem nítida do espectro. |
 |
Espectro de emissão do SolATENÇÃO: NUNCA olhe diretamente para o Sol! |
 |
Espectro de uma lâmpada incandescenteAssim como o Sol, uma lâmpada incandescente emite luz com todos os comprimentos de onda, portanto o espectro de emissão dessa lâmpada é contínuo.A luz emitida pelo filamento aquecido da lâmpada depende somente da temperatura dele. O mesmo acontece com a luz emitida pelo Sol. |
|
Espectro de uma lâmpada fluorescenteUma lâmpada fluorescente emite um espectro discreto com linhas características do vapor de mercúrio contido no interior do tubo.Superposto a essas linhas aparece um espectro contínuo devido à fluorescência do material que reveste o interior dessa lâmpada. O processo de emissão de luz por fluorescência, será discutido no experimento Fluorescência e Fosforescência. Sugere-se que os alunos pesquisem sobre quais são os comprimentos de onda dominantes no espectro do mercúrio. |
 |
Espectro de uma lâmpada de vapor de sódioEstas lâmpadas contém vapor de sódio que emitem uma luz intensa de linhas de cor amarela. No entanto, para tornar a luz emitida mais agradável, os fabricantes acrescentam outros materiais que emitem luz na faixa visível do espectro.Os estudantes podem observar essas lâmpadas que são usualmente utilizadas na iluminação pública de rua e avenidas. |
|
Espectro da luz de um monitor de computadorUma imagem na tela de um computador é constituída de um conjunto de pontos brilhantes chamados pixels. Cada pixel é formado por três fontes de luz muito pequenas e próximas uma do outra, de cores vermelho, verde e azul. A adição de diferentes intensidades dessas cores dá origem às demais cores.Na figura, estão mostrados três círculos coloridos e as cores que são geradas pela superposição deles. Carregue essa imagem para visualizá-la na tela de um computador ou de um telefone celular. Com o espectroscópio, analise a luz emitida por cada região de cor diferente. O espectro é contínuo? Quantas linhas você observa no espectro de cada região? Quais as cores das linhas que você observa nas regiões amarela, magenta, ciano e branca? Por que? |
  |
Espectro da luz refletida por objetosCom a lanterna, ilumine objetos de cores diferentes e observe com o espectroscópio a luz refletida na superfície de cada um deles.Quando iluminado com luz branca, uma folha de papel azul reflete luz com determinados comprimentos de onda que geram essa cor. Os demais comprimentos de onda são absorvidos pelo material. |
|
Espectro de absorção da clorofilaA clorofila é um pigmento existente nas folhas das plantas e que está envolvido no processo de fotossíntese. A clorofila absorve luz principalmente em duas faixas de comprimentos de onda do espectro que correspondem ao azul/violeta e ao laranja/vermelho. Os comprimentos de onda entre essas duas faixas, que estão na região do verde, são refletidos, por isso as folhas têm a coloração verde. Outros pigmentos dão cores diferentes.Para observar a absorção de luz por uma folha, é necessário extrair os pigmentos dela. Para isso, corte uma folha de espinafre ou outro vegetal verde em pedaços pequenos. Coloque-os em um recipiente com 10 ml de álcool e triture as folhas até que restem apenas partes muito pequenas. Acrescente mais 20 ml de álcool e, em seguida, filtre a solução para um copo com um filtro de papel. Descarte o filtro com os restos. Segure o copo transparente com a solução contra a luz e, com o espectroscópio, observe a luz que atravessa a solução. O espectro da luz transmitida é mais intenso na faixa do verde, uma vez que a clorofila absorve comprimentos de onda nas outras faixas. |
 Espectro da clorofila  Espectro de uma lâmpada incandescente |
Espectro de absorção: filtros de luzMateriais transparentes coloridos como plásticos, vidros, folhas, etc., absorvem luz de determinadas faixas de comprimentos de onda.Utilize o espectroscópio para comparar o espectro da luz de uma determinada fonte antes e depois de ela atravessar um desses materiais. Por exemplo, observe o espectro de uma lâmpada fluorescente e, em seguida, ainda com o espectroscópio direcionado para essa lâmpada, coloque na frente da fenda um pedaço de plástico colorido. Analise a diferença entre os dois espectros. Quais comprimentos de onda são absorvidos? Quais são transmitidos? Por que? Repita utilizando diferentes materiais. |
 |
Espectros de outras fontes de luzUtilize o espectroscópio para analisar a luz emitida por outras fontes de luz como o farol de carros (lâmpadas incandescentes e lâmpadas de xenônio), a lua, etc.Analise se o espectro de cada uma é discreto ou contínuo e, a partir dessa observação, pesquise sobre a origem dessa emissão. |